UBIQUITINE
Articles
-
COMMUNICATION CELLULAIRE
- Écrit par Yves COMBARNOUS
- 6 596 mots
- 7 médias
...Ainsi, les auxines, les jasmonates ou les gibbérellines se fixent à des récepteurs cytoplasmiques qui recrutent alors des enzymes de la famille des ubiquitines ligases. Ces dernières ciblent des répresseurs de l’expression de gènes spécifiques de chacune de ces hormones et y fixent une protéine appelée... -
GNF6702, INHIBITEUR DE PROTÉASOMES
- Écrit par Gabriel GACHELIN
- 1 995 mots
- 4 médias
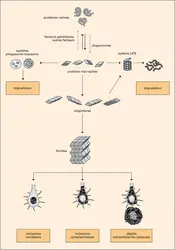
...cellules. Ils ne clivent pas les protéines au hasard, mais seulement celles qui sont « marquées » par une petite protéine de soixante-seize acides aminés, l’ubiquitine. La découverte du rôle conjoint de l’ubiquitine et des protéasomes a été récompensée par le prix Nobel de chimie, en 2004, décerné à A. Ciechanover,... -
MALADIES NEURODÉGÉNÉRATIVES
- Écrit par Nathalie CARTIER-LACAVE, Caroline SEVIN
- 4 618 mots
- 2 médias
...assurer un contrôle de qualité des protéines synthétisées : des protéines « chaperonnes » sont chargées d'assurer un repliement correct de chaque protéine, le « système UPS » (Ubiquitine-Proteasome System) reconnaît et dégrade les protéines anormales, et le système phagosome-lysosome, par sa fonction d'évacuation... -
PROTÉASOME
- Écrit par Yves BRIAND, Universalis
- 2 186 mots
- 2 médias
...partie des protéines cellulaires mais, pour être reconnues par le protéasome 26S puis dégradées, ces protéines devront être au préalable marquées par l'ubiquitine, une protéine de 76 aminoacides qui sert d’indicateur aux protéines devant être dégradées par les protéasomes. Le régulateur 19S possède une... -
ROSE IRWIN (1926-2015)
- Écrit par Universalis
- 418 mots
Le biochimiste américain Irwin Rose partagea le prix Nobel de chimie en 2004 avec les Israéliens Aaron Ciechanover et Avram Hershko pour leur découverte conjointe du procédé par lequel les cellules de la plupart des organismes vivants éliminent les protéines défectueuses ou trop vieilles. À la...
Média