SULFURES
Articles
-
ANTIMOINE
- Écrit par Universalis, Jean PERROTEY
- 3 875 mots
- 3 médias
Lessulfures, correspondant aux deux degrés d'oxydation, sont faciles à préparer par action directe du soufre, en proportions calculées, sur l'antimoine métallique, ou par voie aqueuse, en faisant agir un courant d'hydrogène sulfuré sur une solution acide d'antimoine tri- ou pentaoxydé. Ces sulfures... -
ARGENT, métal
- Écrit par Robert COLLONGUES
- 5 165 mots
- 6 médias
Le sulfure d'argent existe sous deux formes que l'on rencontre toutes deux dans la nature. La forme de basse température correspond à l'acanthite naturelle. La forme de haute température, stable au-dessus de 180 0C et correspondant à l'argentite naturelle, est cubique de type cuprite.... -
ARSENIC
- Écrit par Jean PERROTEY
- 4 498 mots
- 2 médias
Lessulfures As4S3, As4S4, As4S6 et As4S10 peuvent être préparés par voie sèche à partir des éléments en proportions convenables. Par action de l'hydrogène sulfuré sur des solutions contenant de l'arsenic tri- ou pentaoxydé, on obtient facilement As4O6, beaucoup plus difficilement... -
BISMUTH
- Écrit par Anne-Marie TRISTANT
- 2 936 mots
- 4 médias
... s'obtient surtout par action de l'acide fluorhydrique HF sur l'oxyde ou l'hydroxyde. Le soufre réagit sur le métal en fusion : il se forme un sulfure Bi2S3 noir insoluble dans l'eau acidulée même à un pH voisin de 1. On le prépare beaucoup plus facilement par l'action de l'... -
CÉSIUM
- Écrit par Roger NASLAIN
- 1 124 mots
- 3 médias
Lecésium brûle dans la vapeur de soufre en donnant un monosulfure Cs2S et une série de polysulfures Cs2Cn avec n = 2,3,4,5,6. Ces composés de couleur jaune ou rouge, solubles dans l'eau, sont constitués de chaînes d'atomes de soufre terminées par deux atomes métalliques. Les valeurs élevées de ... -
COBALT
- Écrit par Jean AMIEL
- 2 969 mots
- 3 médias
Le sulfure CoS, noir, est obtenu en précipitant les solutions de sels de cobalt (II) par H2S ou par le sulfure d'ammonium, pour un pH > 4. -
CUIVRE
- Écrit par C.I.C.L.A., Jean-Louis VIGNES
- 8 229 mots
- 4 médias
On commence par agglomérer le concentré pulvérulent grâce à l'élévation de la température due à une oxydation partielle des sulfures avec combustion du soufre. Cette opération s'effectue avec un appareil Dwight-Lloyd, sorte de grille mobile à température contrôlée. -
CYCLES BIOGÉOCHIMIQUES
- Écrit par Jean-Claude DUPLESSY
- 7 878 mots
- 6 médias
...SH (méthyl mercaptan), CH3SCH3 (DMS, sulfure de diméthyl), CH3SSCH3 (disulfure de diméthyl). Le DMS est le principal responsable des émissions de sulfure en océan ouvert. Il s'oxyde essentiellement en très fines particules de sulfates, qui servent de noyaux de condensation pour les nuages... -
DORSALES OCÉANIQUES
- Écrit par Jean FRANCHETEAU
- 5 389 mots
- 10 médias
...spectaculaires de l'activité hydrothermale, qui crachent, à une vitesse de 1 à 2 mètres par seconde dans l'eau abyssale à 2-3 0C, un fluide chargé de sulfures de fer, de cuivre et de zinc qui se déposent, au contact de l'eau, pour former cheminées et monticules de sulfures atteignant plusieurs dizaines... -
FER - L'élément métallique
- Écrit par Simone TALBOT-BESNARD
- 2 771 mots
- 10 médias
Le diagramme de la figure 9 indique les domaines d'existence des deux seuls composés fer-soufre. Le sulfure ferreux FeS tolère de larges écarts à la composition stœchiométrique, tant par excès de fer que par excès de soufre vis-à-vis du rapport 1/1. Des solutions solides dans lesquelles le fer... -
LITHIUM
- Écrit par Universalis, Roger NASLAIN
- 2 065 mots
- 3 médias
-
MERCURE, élément chimique
- Écrit par Guy PÉREZ, Jean-Louis VIGNES
- 2 296 mots
- 3 médias
...mercure Hg(OH)2 existe en solution aqueuse, mais n'a jamais pu être isolé ; il est amphotère, mais à caractère très faiblement basique :Le sulfure mercurique HgS fraîchement précipité est noir, son produit de solubilité est très faible (10—54), le sulfure noir se transforme par chauffage...
-
ORIGINE DE LA VIE
- Écrit par André BRACK
- 11 477 mots
...molécules organiques primordiales se forment par réduction du dioxyde de carbone atmosphérique grâce à la réaction de l' hydrogène sulfuré (H2S) sur le sulfure de fer (FeS). Cette réaction produit également de la pyrite (FeS2), capable d'adsorber les molécules organiques formées. En laboratoire, le... -
PHOSPHORE
- Écrit par François MATHEY, Maurice MAURIN, Maurice SLANSKY
- 8 988 mots
- 15 médias
Mélangés à une température inférieure à 100 0C, le phosphore blanc et le soufre forment des solutions solides ; au-dessus de cette température, ils réagissent d'une manière énergique et très exothermique. -
PLOMB
- Écrit par Claude FOUASSIER, Michel PÉREYRE, Michel RABINOVITCH, Jean-Louis VIGNES
- 6 736 mots
- 2 médias
Le plomb et le zinc se trouvent très généralement dans la nature sous forme de sulfures : galène (PbS) et blende (ou sphalérite, ZnS). Des gisements de plomb et de zinc oxydés sont connus, mais ils sont le plus souvent de petite dimension. -
POTASSIUM
- Écrit par André HATTERER, Henri KESSLER
- 2 934 mots
La vapeur de soufre, vers 250 0C, conduit au sulfure K2S blanc déliquescent. Il existe divers polysulfures K2Sn (n = 2 à 6), dont les couleurs vont du jaune au rouge. -
SILICIUM
- Écrit par Jacques DUNOGUÈS, Michel POUCHARD
- 5 562 mots
- 1 média
Enfin, le soufre forme avec le silicium un sulfure SiS2, formé de tétraèdres mettant en commun deux arêtes opposées pour former des chaînes polymériques (SiS2)n. -
SODIUM
- Écrit par Luc AUFFRET, Albert HÉROLD, André METROT, Bernard PIRE
- 4 651 mots
- 2 médias
Le soufre forme le sulfure Na2S incolore, soluble dans l'eau, et, s'il est en excès, des polysulfures Na2Sn (n = 2, 3, 4, 5) colorés en jaune ou orangé. -
SOUFRE
- Écrit par Fernande CHATAGNER, René LECLERCQ, Noël LOZAC'H, Serge MASSON
- 6 532 mots
- 13 médias
Les sulfures R—S—R′ correspondent aux oxydes (éthers-oxydes) R—O—R′, mais le soufre est un meilleur nucléophile que l'oxygène, c'est-à-dire qu'il est plus efficace pour se substituer à des groupes ou des atomes électronégatifs comme le brome et l'iode fixés sur une molécule organique. Il en résulte que... -
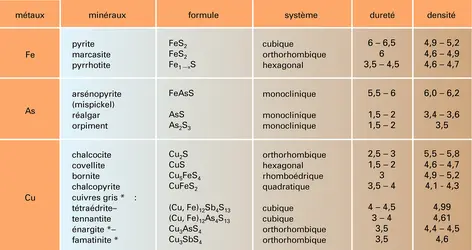
SULFURES ET SULFOSELS NATURELS
- Écrit par Roland PIERROT, Guy ROGER
- 6 075 mots
- 13 médias
- 1
- 2
Média