SUBSTITUTION, chimie
Articles
-
ACÉTIQUE ACIDE
- Écrit par Jacques METZGER
- 2 111 mots
- 3 médias
À côté de ces propriétés acides, l'éthanoïque se prête aux réactions habituelles des composés organiques et en particulier à des réactions de substitution. Les trois hydrogènes du méthyle sont remplaçables par des halogènes. Cette substitution par des éléments très électronégatifs... -
ALCANES
- Écrit par Jacques METZGER
- 3 614 mots
- 11 médias
Lesréactions de substitution des alcanes sont à peu près exclusivement radicalaires. L'alcane est attaqué par un radical libre qui arrache un atome d'hydrogène. Il se transforme lui-même en radical libre qui est d'autant plus stable que le carbone porteur de l'électron célibataire est plus substitué... -
ALCYNES
- Écrit par Jacques METZGER
- 3 301 mots
- 5 médias
Ce sont des réactions qui concernent la substitution de l'hydrogène acétylénique et qui conservent la triple liaison. -
AMINES
- Écrit par Jacques METZGER
- 3 232 mots
- 4 médias
Les amines primaires et secondaires sont des réactifs nucléophiles qui interviennent dans de nombreuses réactions de substitution. -
ANILINE
- Écrit par Alain TRINQUIER
- 1 375 mots
- 2 médias
Les substitutions sur le noyau aromatique sont orientées en positions ortho- et para-. L'acide sulfurique conduit à l'acide sulfanilique (formule 3). -
AROMATICITÉ
- Écrit par André JULG
- 4 706 mots
- 2 médias
...seront eux qui réagiront. Ils seront attaqués essentiellement par des systèmes avides d'électrons (réactifs électrophiles) : ions positifs ou radicaux. Le principal type de réaction susceptible de se produire est la substitution électrophile.Prenons comme exemple le benzène. Soit R+ un édifice positif... -
BENZÈNE
- Écrit par Dina SURDIN
- 477 mots
Le plus simple des hydrocarbures aromatiques.
Formule : C6H6
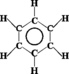
Fréquemment symbolisé par :
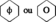
Masse moléculaire : 78,11 g
Masse spécifique : 0,88 g/cm3
Point de fusion : 5,5 0C
Point d'ébullition : 80,09 0C.
Cristaux incolores dans le système orthorhombique bipyramidal. Forme un azéotrope...
-
BENZÉNOÏDES
- Écrit par Jacques METZGER
- 5 520 mots
- 6 médias
..., par la tendance que présente le système conjugué cyclique à se reformer au cours de réactions où, temporairement, il aurait été désorganisé ; de cette stabilité remarquable du système π résulte la possibilité, pour les composés aromatiques, d'entrer dans des réactions de substitution ; par la... -
CARBONE
- Écrit par Jean AMIEL, Henry BRUSSET
- 8 257 mots
- 11 médias
a) Réactions de substitution. On peut substituer aux molécules terminales d'oxyde de carbone, comme à celles qui forment des ponts entre noyaux métalliques, des atomes d'halogène ou diverses molécules et obtenir ainsi de nombreux dérivés conservant une partie de l'oxyde de carbone. -
COORDINATION (chimie) - Composés de coordination
- Écrit par Jean AMIEL, Jean-Pierre SCHARFF
- 4 894 mots
- 4 médias
Ces réactions sont des substitutions nucléophiles (SN) que l'étude cinétique permet de classer en deux groupes : -
DYNAMIQUE MOLÉCULAIRE
- Écrit par Jean RIESS
- 5 166 mots
- 17 médias
Voyons comment évolue le spectre de R.M.N. d'une molécule en fonction de la température lorsque des atomess'échangent entre des sites non équivalents. Prenons l'exemple du pentaméthoxyniobium, de formule Nb (OCH3)5, dont la structure dimère Nb2(OCH3)10, rigide dans le solide, a été... -
KEKULE VON STRADONITZ FRIEDRICH AUGUST (1829-1896)
- Écrit par Jacques GUILLERME
- 2 160 mots
- 1 média
...latérale ». Tout ce qu'énonce Kekulé en cette occasion a été sanctionné par l'expérience, et les objections qu'on lui fera ont été infirmées. Les dérivés de substitution prévus par la théorie ont été successivement identifiés. La constitution qu'il suppose pour le benzène C6H6 implique l'équivalence... -
LAURENT AUGUSTE (1807-1853)
- Écrit par Jacques GUILLERME
- 1 179 mots
...se préoccupait également de l'action des halogènes sur les composés organiques simples, ce qui lui donnera l'occasion de décrire les phénomènes desubstitution, en 1834. Il avait engagé Laurent à préparer, purifier, analyser des hydrocarbures aromatiques et à en étudier la réactivité. -
PHÉNOLS
- Écrit par Jacques METZGER
- 3 352 mots
- 2 médias
Toutefois, par une transposition semi-dinique, beaucoup de dérivés de substitution à l'oxygène s'isomérisent plus ou moins facilement mais irréversiblement (6). -
SILICIUM
- Écrit par Jacques DUNOGUÈS, Michel POUCHARD
- 5 562 mots
- 1 média
...organique ; il est ainsi possible de substituer le groupe triméthylsilyle régio-(voire stéréo-) spécifiquement par un groupement électrophile ; c'est la substitution ipso (cas des vinyl-, éthynyl-, aryl-, etc., silanes, mais aussi cyclopropylsilanes non substitués), soit, et c'est le cas des allylsilanes,...


