ÉLECTRONIQUE STRUCTURE
Articles
-
AGRÉGATS, physico-chimie
- Écrit par Jean FARGES, Rémi JULLIEN
- 1 616 mots
- 7 médias
Dans un agrégat métallique suffisamment petit, les électrons de conduction ne peuvent plus sauter d'un état quantique à l'autre car la différence d'énergie entre deux états successifs (qui varie comme 1/N) devient plus grande que l'énergie thermique. Par conséquent, lorsque la valence du métal considéré... -
ALCÈNES ou OLÉFINES
- Écrit par Jacques METZGER
- 3 640 mots
- 4 médias
La structure électronique de la double liaison de l'éthylène est décrite par deux orbitales moléculaires de symétries σ et π qui résultent du recouvrement longitudinal important des fonctions hybrides sp2 et de celui, latéral, des orbitales 2pz. Le plan nodal ou d'antisymétrie de la fonction... -
ALCOOLS
- Écrit par Jacques METZGER
- 5 832 mots
- 8 médias
Comptetenu de la grande électronégativité de l'oxygène, la molécule d'alcool connaît, au niveau du groupe fonctionnel, une importante polarisation des liaisons C −>− O et O −<− H. Celle-ci induit, dans le squelette hydrocarboné, une polarisation monotone des liaisons adjacentes, qui s'amortit... -
ALCYNES
- Écrit par Jacques METZGER
- 3 301 mots
- 5 médias
Laliaison acétylénique résulte du recouvrement longitudinal des orbitales hybrides sp des deux atomes de carbone, formant une orbitale moléculaire liante de symétrie σ, et du recouvrement latéral des deux couples d'orbitales py et pz formant deux orbitales moléculaires liantes de symétrie... -
ALDÉHYDES ET CÉTONES
- Écrit par Jacques METZGER
- 7 350 mots
- 4 médias
Lastructure électronique de la fonction carbonyle dans le modèle orbitalaire est définie par le partage par les atomes de carbone sp2 et d'oxygène sp2, de deux doublets d'électrons décrits respectivement par deux orbitales moléculaires, l'une de symétrie σ, résultant du recouvrement (longitudinal)... -
ANDERSON PHILIP WARREN (1923-2020)
- Écrit par Bernard PIRE
- 790 mots
Physicien américain, colauréat du prix Nobel de physique en 1977 « pour ses recherches théoriques fondamentales sur la structure électronique des systèmes magnétiques et désordonnés ».
Né le 13 décembre 1923 à Indianapolis (Indiana), Philip Warren Anderson est le fils d'un professeur de...
-
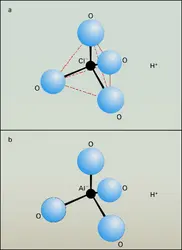
ARGENT, métal
- Écrit par Robert COLLONGUES
- 5 165 mots
- 6 médias
La structure électronique de l'argent est :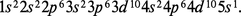
-
AROMATICITÉ
- Écrit par André JULG
- 4 706 mots
- 2 médias
-
ATOME
- Écrit par José LEITE LOPES
- 9 140 mots
- 13 médias
La valeur de n = 1 détermine ce qu'on appelle la couche K, qui est saturée par deux électrons. La valeur n = 2 détermine la couche L saturée par huit électrons, car si n = 2, on aura deux électrons avec l = 0, ml = 0 et ms = 1/2 ou — 1/2, et six électrons avec ... -
AZOTE
- Écrit par Universalis, Paul HAGENMULLER
- 4 443 mots
- 4 médias
-
BANDES D'ÉNERGIE THÉORIE DES
- Écrit par Daniel CALÉCKI
- 946 mots
-
BENZÉNOÏDES
- Écrit par Jacques METZGER
- 5 520 mots
- 6 médias
Lastructure électronique des hydrocarbures benzénoïdes est caractérisée par une conjugaison cyclique de leur système électronique π. Responsable de l'ensemble des propriétés spécifiques de ces hydrocarbures et de leurs dérivés fonctionnels, cette conjugaison cyclique se manifeste de diverses... -
CARBOXYLIQUES ACIDES
- Écrit par Jacques METZGER
- 5 503 mots
- 6 médias
La structure électronique du groupe carboxylique est caractérisée par la conjugaison interne du système π, qui a pour conséquence une coplanéité des trois atomes du groupe CO2, tous trois hybrides sp2 (fig. 1). Dans l'ion carboxylate, —CO2–, deux doublets de symétrie p ou π sont partagés... -
CHIMIE - La chimie aujourd'hui
- Écrit par Pierre LASZLO
- 10 856 mots
- 3 médias
Les formules de structure qu'écrivent les chimistes dérivent d'une aporie, la localisation des électrons, par paires, entre les atomes. Tout électron est au contraire délocalisé sur l'ensemble d'une molécule. La chimie quantique a comme objectif de déterminer cette distribution électronique, de... -
CHIMIE THÉORIQUE
- Écrit par Lionel SALEM, François VOLATRON
- 4 288 mots
- 10 médias
L'opérateur hamiltonien Hop contient à la fois un terme différentiel, assimilable à l'énergie cinétique des particules, et un terme multiplicatif, assimilable à leur énergie potentielle. C'est la présence simultanée de ces deux termes de caractère mathématique très différent qui rend la résolution... -
DEBYE PETER JOSEPH WILLEM (1884-1966)
- Écrit par P. M. HEIMANN
- 1 236 mots
...atomes dans les cristaux, Debye et B. Scherrer, en 1916, étendirent la méthode à l'analyse des poudres et l'appliquèrent en 1918 à la détermination de la configuration du cortège électronique des atomes eux-mêmes. Ils avaient, à ce sujet, accepté le modèle d'atome donné par N. Bohr en 1913... -
DIPOLAIRES MOMENTS
- Écrit par Jean BARRIOL
- 4 731 mots
- 8 médias
...sont utilisés dans la comparaison de molécules de structures voisines, mais il leur enlève toute signification physique. Le rôle joué par ces doublets électroniques devient d'ailleurs manifeste quand on veut interpréter la différence entre le moment de l'ammoniac (1,47 D) et celui du trifluorure... -
EXCITON
- Écrit par Viorel SERGIESCO
- 596 mots
Quasi-particule utilisée en physique quantique pour décrire la propagation de l'énergie dans un diélectrique ou dans un semiconducteur par le mécanisme du transfert graduel (d'une molécule à la suivante). L'énergie transférée est une énergie d'excitation (« transfert d'excitation...
-
FRIEDEL JACQUES (1921-2014)
- Écrit par Bernard PIRE
- 705 mots
Né le 11 février 1921 à Paris et décédé le 27 août 2014, le physicien Jacques Friedel a été un des acteurs majeurs en France du développement de la physique théorique des solides. Il a notamment contribué avec succès à l’élucidation de la structure électronique des composés métalliques et à l'étude...
-
LANTHANE ET LANTHANIDES
- Écrit par Concepcion CASCALES, Patrick MAESTRO, Pierre-Charles PORCHER, Regino SAEZ PUCHE
- 11 268 mots
- 18 médias
Les propriétés des terres rares sont intimement liées à leurs configurations électroniques (tabl. 6). Celles des atomes neutres sont [Xe]6s24fN+1, [Xe] représentant la configuration électronique à couches complètes du xénon. N, le nombre d'électrons 4f, varie de 0 à 14 avec le numéro atomique...
- 1
- 2
Médias