STABILITÉ, chimie
Articles
-
AGRÉGATS, physico-chimie
- Écrit par Jean FARGES, Rémi JULLIEN
- 1 616 mots
- 7 médias
...nombre N d'atomes ou de molécules qu'ils contiennent. Ainsi, les spectres de masses, pour certaines valeurs de N appelées « nombres magiques », font apparaître que les agrégats sont plus abondants et donc particulièrementstables. Cette information est utilisée pour la détermination de leur structure. -
AROMATICITÉ
- Écrit par André JULG
- 4 706 mots
- 2 médias
...indépendantes, mais forment un nuage continu qui s'étend sur toute la molécule, c'est que l'énergie du système est plus basse dans ce dernier état. En d'autres termes, la conjugaison se traduit par une stabilisation du système. L'abaissement de l'énergie est appelé énergie de conjugaison... -
BENZÈNE
- Écrit par Dina SURDIN
- 477 mots
Le plus simple des hydrocarbures aromatiques.
Formule : C6H6
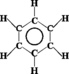
Fréquemment symbolisé par :
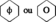
Masse moléculaire : 78,11 g
Masse spécifique : 0,88 g/cm3
Point de fusion : 5,5 0C
Point d'ébullition : 80,09 0C.
Cristaux incolores dans le système orthorhombique bipyramidal. Forme un azéotrope...
-
CHIMIE THÉORIQUE
- Écrit par Lionel SALEM, François VOLATRON
- 4 288 mots
- 10 médias
...benzoïdes). Terme utilisé originellement pour caractériser l'odeur forte de ces molécules, l'« aromaticité » a depuis pris le sens d'unestabilité exceptionnelle de ces molécules hydrocarbonées cycliques ou polycycliques par rapport aux molécules analogues à chaînes ouvertes. -
COLLOÏDES
- Écrit par Didier ROUX
- 6 009 mots
Le principe de la stabilisation colloïdale a été proposé dans deux articles célèbres, l'un de Derjaguin et de Landau (1941) et l'autre de Verwey et d'Overbeek (1948). Il est plus connu sous le nom de théorie D.L.V.O. (initiales des auteurs). Dans ces articles, les auteurs expliquent que l'on peut stabiliser... -
COMPLEXES, chimie
- Écrit par René-Antoine PARIS, Jean-Pierre SCHARFF
- 4 304 mots
- 5 médias
...concentrations en moles par litre. Au dénominateur figurent les concentrations libres (espèces non liées) des ions métalliques, des protons et des coordinats. La stabilité ionique du complexe est donnée par la valeur de log10 βpqrs, indiquée dans les tables de constantes spécialisées. Le complexe sera d'autant... -
COORDINATION (chimie) - Chimie de coordination
- Écrit par René POILBLANC
- 3 996 mots
- 12 médias
La chimie de coordination a puisé une part importante de sa dynamique dans la recherche des moyens propres à stabiliser des états d'oxydation particuliers et des états de coordinences non usuelles. -
COORDINATION (chimie) - Composés de coordination
- Écrit par Jean AMIEL, Jean-Pierre SCHARFF
- 4 894 mots
- 4 médias
...environnement à 18 électrons. On a souvent postulé que les complexes satisfaisant à cette règle dite du gaz rare, ou règle des 18 électrons, étaient dotés d'une stabilité particulière, et on a souvent utilisé cette règle pour déterminer les stœchiométries des composés de coordination. Là encore, les données récentes... -
EAU - Propriétés physico-chimiques
- Écrit par Antoine POTIER
- 2 238 mots
- 4 médias
L'eau est un réactif très important dans l'état gazeux et surtout dans l'état liquide. C'estun composé très stable avec, pour sa réaction de formation à 25 0C :ce qui conduit à une vapeur d'eau très peu dissociée, même à température élevée (2 p. 100 à 2 000 0C, 60 p....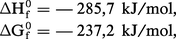
-
ÉLÉMENTS NATIFS
- Écrit par Guy ROGER
- 2 071 mots
- 3 médias
Un élément est dit « natif » lorsqu'il se trouve à l'état de corps simple, non combiné à d'autres éléments. Les gaz rares (hélium, néon, argon, krypton, xénon, radon), chimiquement inertes, n'entrent dans aucune combinaison et sont donc toujours à l'état natif. Dans la croûte...
-
HYDROGÈNE
- Écrit par Paul HAGENMULLER
- 3 539 mots
- 6 médias
...distance interatomique au sein de la mo lécule H2 est de 0,074 nm. L'enthalpie de dissociation (431,9 kJ ( mole-1) est relativement élevée : la stabilité thermique explique qu'à une pression d'un bar, un dix-millionième seulement des molécules soient dissociées à 1 000 K et 62 p. 100 à 4 000 K.... -
LIAISONS CHIMIQUES - Liaison et classification
- Écrit par André JULG
- 8 249 mots
- 7 médias
...distance R0. Une modification de la distance à partir de cette valeur entraîne, dans tous les cas, une augmentation de l'énergie, donc une perte de stabilité. La distance R0 correspond par conséquent à une position d'équilibre stable. On dit qu'il y a liaison chimique, la valeur absolue de ... -
LIAISONS CHIMIQUES - Liaison hydrogène
- Écrit par André JULG
- 3 328 mots
- 2 médias
Enfin, ce modèle explique que le maximum de stabilité, qui correspond à l'alignement des dipôles, exige que la liaison hydrogène soit linéaire en l'absence de contrainte extérieure, sans pour cela la rendre impossible dans ces derniers cas. -
LIAISONS CHIMIQUES - Liaisons biochimiques faibles
- Écrit par Antoine DANCHIN
- 5 900 mots
- 9 médias
...substrats et des effecteurs. Si l'une est active et l'autre inactive, on conçoit aisément que l'association de molécules à la première tende à accroître sa stabilité et donc à favoriser l'activité (il s'agira donc d'effecteurs allostériques positifs), alors que l'association de molécules à la seconde accroîtra... -
NANOPARTICULES
- Écrit par Pierre-Gilles DE GENNES, Madeleine VEYSSIÉ
- 1 987 mots
- 4 médias
...particules d'or, bien trop petites pour être décelées au microscope, qui confèrent à celle-ci son éclatante couleur ; le système n'est pas, en principe, stable sous cette forme, car les particules formées tendent à s'agréger puis à précipiter. Dans le cas des sols d'or, les nanoparticules synthétisées portent... -
QUASI-CRISTAUX
- Écrit par Marc AUDIER, Michel DUNEAU
- 3 072 mots
- 4 médias
...transforme au profit d’une forme cristalline sous l’effet d’un traitement thermique, la structure quasi-cristalline pouvait être considérée comme moins stable et donc moins bien ordonnée que celle du cristal, et semblait constituer en quelque sorte une structure intermédiaire entre celle d’un liquide (ou... -
RÉFRACTAIRES MATÉRIAUX
- Écrit par Jean-Pierre TRAVERSE
- 2 081 mots
Lastabilité est une propriété essentielle pour les applications à haute température, et le problème ne peut être dissocié de celui du comportement du matériau par rapport à l'atmosphère gazeuse coexistante. Celle-ci joue un rôle capital, tant par sa nature que par la valeur de sa pression. Dans le vide,... -
RÉSONANCE, chimie
- Écrit par André JULG
- 1 482 mots
- 1 média
...noyau benzénique. Sans atteindre ce degré d'importance, le phénomène subsiste dans des molécules comme le butadiène où les doubles liaisons sont encore reconnaissables. Cette réorganisation des électrons est aussi connue sous le nom de conjugaison des systèmes insaturés. Cette appellation est préférable... -
SATURATION, chimie organique
- Écrit par Dina SURDIN
- 189 mots
Processus de transformation des liaisons multiples d'une molécule en liaisons simples. Les réactions d'addition se produisent donc sur des liaisons multiples. Les liaisons π sont moins solides que les liaisons σ et les produits saturés seront donc plus stables que les composés de départ. Par...
-
STÉRÉOCHIMIE - Stéréochimie organique
- Écrit par Henri B. KAGAN, Charles PRÉVOST
- 14 048 mots
- 12 médias
...inverse de celle constatée pour les petits cycles (pour n = 6, 1200 au lieu de 1090 28′, et pour n très grand, 1800 au lieu de 1090 28′). Or, on constate que pour n ≥ 5 tous les cycles présentent une grande stabilité ; on en conclut que pour n > 5 les cycles ne sont plus plans. En effet,...
Médias




