SITE ACTIF, biochimie
Articles
-
ABZYMES
- Écrit par Joël CHOPINEAU, Universalis, Alain FRIBOULET, Sabine PILLE, Daniel THOMAS
- 1 038 mots
...celle qui utilise les analogues d'états de transition, consiste à faire effectuer par un anticorps une copie plus ou moins fidèle de la structure du site actif d'une enzyme, en utilisant les propriétés du réseau idiotypique décrit par Jacques Oudin vers 1960. Il est possible d'obtenir un premier... -
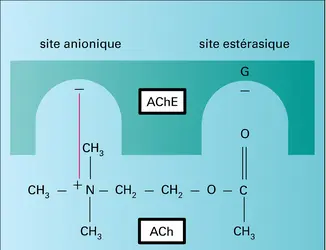
ENZYMES - Site actif
- Écrit par Gabriel GACHELIN
- 3 957 mots
- 4 médias
Considérons une enzyme E et son substrat S. La découverte de Michaelis et Menten a consisté en la démonstration que la condition du pouvoir catalytique d'une enzyme est la formation, entre celle-ci et son substrat, d'un complexe, appelé ES, dans lequel le substrat est fixé de manière spécifique et réversible... -
LIAISONS CHIMIQUES - Liaisons biochimiques faibles
- Écrit par Antoine DANCHIN
- 5 900 mots
- 9 médias
...Comme tout catalyseur, une enzyme n'intervient dans la réaction que pour en accélérer la vitesse et sans être consommée au cours du processus d'activation. Ce qui est important, par conséquent, c'est la vitesse de rotation des substrats et des produits de la réaction au site catalytique de l'enzyme. -
MANGANÈSE
- Écrit par Bernard DUBOIS, Jacques FAUCHERRE, Gil MICHARD, Clotilde POLICAR, Jean-Louis VIGNES
- 6 408 mots
- 7 médias
...dépolymériser par voie oxydante la lignine, polymère structurant du bois protégeant la cellulose contre les agressions extérieures de nature diverse. Cette enzyme possède à son actif un Mn(II) qui est, au cours du cycle catalytique, oxydé en Mn(III). Le site du Mn(II) est enfoui au cœur de la protéine.... -
PHARMACOLOGIE
- Écrit par Edith ALBENGRES, Jérôme BARRE, Pierre BECHTEL, Jean-Cyr GAIGNAULT, Georges HOUIN, Henri SCHMITT, Jean-Paul TILLEMENT
- 20 323 mots
- 9 médias
Dans le meilleur des cas, lorsqu'on dispose de la structure 3D du site actif, on recherche quelles sont les structures qui s'adaptent le mieux à ce site. On détermine ainsi un site actif à l'intérieur duquel on simule ensuite la présence d'une petite molécule (programmes de docking). -
PROTÉASOME
- Écrit par Yves BRIAND, Universalis
- 2 186 mots
- 2 médias
...centrale, entourée de deux anneaux β possédant la fonction catalytique, est en contact avec deux antichambres délimitées par un anneau α et un anneau β. Chez les eucaryotes, trois des sept sous-unités β présentent un site actif fonctionnel, respectivement de type chymotrypsine, trypsine et caspase. Ces trois... -
RIBOSOMES
- Écrit par Carlo COCITO
- 4 724 mots
- 7 médias
La formation du lien peptidique −CO− NH−, réaction clef de la synthèse protéique, est réalisée par le centre catalytique de la peptidyl-transférase, un domaine de la grande sous-unité ribosomale. Ce centre serait constitué par des segments de l'ARNr 23 S et par une série de protéines r situées... -
RIBOZYMES
- Écrit par Joël CHOPINEAU, Alain FRIBOULET, Sabine PILLE, Daniel THOMAS
- 348 mots
À l'instar des protéines enzymatiques, certaines molécules d'ARN, les ribozymes, possèdent naturellement des propriétés catalytiques.
Le prix Nobel de chimie décerné en 1989 conjointement à Sydney Altman et à Thomas Cech a ainsi mis l'accent sur une découverte inattendue qui a bouleversé...
Médias