NUCLÉAIRE (notions de base)
Depuis la découverte de la radioactivité en 1896 par Henri Becquerel et celle du noyau atomique par Ernest Rutherford en 1911, des progrès scientifiques importants ont été accomplis en physique nucléaire. La maîtrise des réactions nucléaires a permis en particulier, dès le milieu du xxe siècle, la mise au point des réacteurs et des armements nucléaires.
Malgré son abandon par de nombreux pays et les oppositions qu’elle suscite en raison des risques qu’elle présente pour les populations et l’environnement, l’énergie nucléaire est toujours tenue, spécialement en France, pour la seule véritable solution permettant de répondre aux besoins énergétiques de demain.
Le noyau de l’atome
Les propriétés nucléaires d’un atome dépendent de ses nucléons, c’est-à-dire de l’ensemble des protons et des neutrons qui constituent son noyau. Des transformations nucléaires affectent certains noyaux instables, qui se changent en noyaux plus stables.
Au cœur de la matière
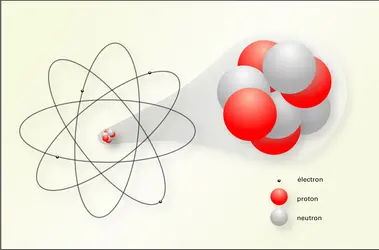
Un atome est constitué d’un noyau extrêmement dense de charge électrique positive, entouré d’un cortège d’électrons chargés négativement. Le noyau concentre presque toute la masse de l’atome ; quant au nuage d’électrons, il s’étend à une distance cent mille fois plus grande que la taille du noyau. Le volume de l’atome est donc essentiellement constitué de vide.
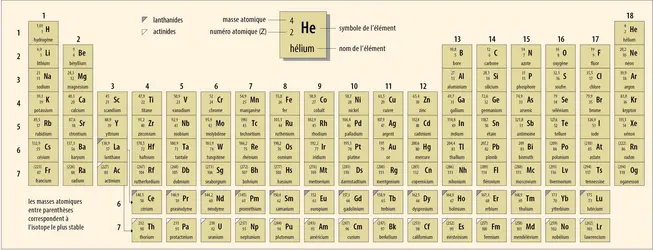
Les nucléons qui composent les noyaux atomiques sont de deux types : des protons chargés positivement et des neutrons sans charge électrique. L’atome étant électriquement neutre, le nombre de protons est donc égal au nombre d’électrons. C’est ce nombre, ou numéro atomique, qui rend compte de la position des éléments dans le tableau périodique de Mendeleïev.
Néanmoins, les noyaux de même numéro atomique ne contiennent pas tous le même nombre de neutrons. Ces isotopes d’un même élément chimique possèdent des propriétés chimiques identiques, mais des propriétés nucléaires différentes. Par exemple, l’uranium naturel contient environ 0,7 p. 100 d’uranium 235 (92 protons + 143 neutrons) et environ 99,3 p. 100 d’uranium 238 (92 protons + 146 neutrons).
La cohésion du noyau est assurée par l’interaction nucléaire forte, la plus intense des quatre forces fondamentales. Dans la nature, la majorité des atomes sont stables. Mais certains assemblages de nucléons, dits radioactifs, sont instables et tendent à se transformer en d’autres noyaux de numéro atomique plus petit. Cette transformation naturelle est appelée désintégration. Elle s’accompagne d’une émission de particules chargées électriquement.
Chaque isotope radioactif est caractérisé par une période radioactive qui est, par définition, le temps nécessaire à la désintégration de la moitié de la population initiale de noyaux. La période radioactive des éléments varie de quelques fractions de seconde à des milliards d’années.
Du fait de leur très courte période, certains noyaux n’existent plus dans la nature. Il est cependant possible de les recréer et d’étudier leurs transmutations. Il s’agit de la radioactivité artificielle, phénomène strictement identique à la radioactivité naturelle affectant les noyaux ayant une période assez longue pour subsister aujourd’hui dans la nature.
Fission et fusion nucléaires
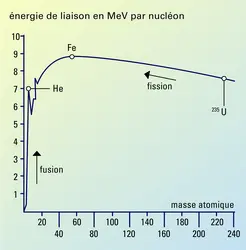
L’énergie qui maintient les nucléons dans un noyau est appelée énergie de liaison. La masse d’un noyau stable est inférieure à la somme des masses de ses nucléons et l’énergie de liaison correspond à cette différence. Celle-ci se calcule par la formule d’Albert Einstein E = mc², qui permet d’expliquer que la masse peut se transformer en énergie. Pour casser un noyau, il est nécessaire de fournir une énergie au moins égale à l’énergie de liaison.
L’énergie de liaison n’est pas identique pour tous les noyaux. Elle augmente avec le numéro atomique, depuis les noyaux légers jusqu’au[...]
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Universalis : services rédactionnels de l'Encyclopædia Universalis
Classification
Pour citer cet article
Universalis. NUCLÉAIRE (notions de base) [en ligne]. In Encyclopædia Universalis. Disponible sur : (consulté le )
Médias
Voir aussi
- TOMOGRAPHIE PAR ÉMISSION DE POSITONS (TEP)
- ISOTOPES
- NOYAU ATOMIQUE
- SCINTIGRAPHIE ou GAMMAGRAPHIE, médecine
- RÉACTEUR À EAU PRESSURISÉE (REP) ou PWR (pressurised water reactor)
- RÉACTEUR À EAU BOUILLANTE (REB) ou BWR (boiling water reactor)
- RÉACTEUR À EAU LOURDE
- RÉACTEUR À GRAPHITE-GAZ
- ENCEINTE DE CONFINEMENT, génie nucléaire
- RADIOÉLÉMENTS ou RADIONUCLÉIDES ou ISOTOPES RADIOACTIFS
- RADIOTHÉRAPIE
- RÉACTEUR À NEUTRONS RAPIDES (RNR)
- NUCLÉAIRES RÉACTIONS
- COMBUSTIBLE NUCLÉAIRE
- SURGÉNÉRATEURS
- RÉACTION EN CHAÎNE, physique nucléaire
- FISSION NUCLÉAIRE
- NUCLÉONS
- MODÉRATEUR, génie nucléaire
- PÉRIODE ou DEMI-VIE, radioactivité
- RAYONNEMENTS IONISANTS ou RADIATIONS IONISANTES
- ÉNERGIE NUCLÉAIRE
- BOMBE ATOMIQUE
- ÉNERGIE DE LIAISON
- FUSION THERMONUCLÉAIRE CONTRÔLÉE
- FUSION NUCLÉAIRE
- CŒUR, génie nucléaire
- CENTRALE NUCLÉAIRE
- RÉACTEUR NUCLÉAIRE
- ACCIDENTS NUCLÉAIRES
- NUCLÉAIRE INDUSTRIE
- TNP (Traité de non-prolifération)
- DÉCHETS RADIOACTIFS ou DÉCHETS NUCLÉAIRES
- DÉSINTÉGRATION, physique
- CYCLE, génie nucléaire
- RADIOACTIVITÉ ARTIFICIELLE
- SÛRETÉ NUCLÉAIRE
- TCHERNOBYL
- EXPLOSION NUCLÉAIRE
- ÉNERGIE ÉLECTRIQUE
- RISQUES TECHNOLOGIQUES