MANGANÈSE
Composés
Tous les degrés d'oxydation du manganèse, de zéro à + VII, sont connus. On trouvera, dans le tableau 3, quelques exemples de composés simples ou complexes ou d'oxyanions, ainsi que leur structure en relation avec le nombre de coordination du manganèse dans ces composés.
D'une manière générale, le caractère acide de ces cations croît avec l'augmentation du degré d'oxydation (diminution du rayon et augmentation de la charge de l'ion). Ainsi, Mn(OH)2 est une base assez forte, MnO2 est amphotère et HMnO4 est un acide fort.
Signalons l'existence de trois degrés d'oxydation très instables : — I dans [Mn(CO)5]—, ainsi que — II et — III, qui correspondent à des composés extrêmement réducteurs.
Il est à noter que l'intérêt des chimistes inorganiciens et, plus particulièrement, des chimistes de coordination à l'égard des complexes du manganèse est relativement récent. Ainsi, ce n'est qu'en 1973 que le premier volume du système Gmelin concernant le manganèse est publié. On peut rappeler que l'entreprise de l'encyclopédie Gmelin, dont le but est de recenser les composés inorganiques, remonte à 1852 (signalons que le premier volume concernant le magnésium est publié en 1937). Un tel dédain peut s'expliquer par la prépondérance du degré d'oxydation II (degré d'oxydation le plus stable) et le manque de techniques immédiates de caractérisation de la géométrie pour cet état rédox. À partir du début de la décennie 1980 cependant, la multiplication des découvertes de systèmes biologiques impliquant le manganèse a mis en évidence l'importance de cet élément, ce qui n'a rien de surprenant étant donné son abondance assez élevée dans l'écorce terrestre. Cela a entraîné une recrudescence d'attention pour ce métal, ces ions et leurs complexes et fait découvrir aux chimistes tout un pan de la chimie des hauts degrés d'oxydation du manganèse (en particulier III et IV). En atteste l'accroissement du nombre de volumes du Gmelin consacré à cet ion métallique : on dénombrait en 1994 vingt et un volumes consacrés au manganèse, le plus récent datant de 1993, contre seulement huit au magnésium, le plus récent datant de 1952 !
Degré d'oxydation + II
Le Mn(II) a pour structure électronique 4s0 3d5. Le degré d'oxydation +II est le plus stable des degrés d'oxydation du manganèse. Il est plus difficile à oxyder que Cr(II) et Fe(II). Les sels manganeux sont roses en solution et à l'état cristallisé. On les obtient par attaque acide du métal. Citons l'oxyde MnO ; l'hydroxyde Mn(OH)2, peu soluble, qui s'oxyde à l'air en brunissant ; les halogénures MnX2, plus ou moins hydratés ; le sulfate [Mn(H2O)6SO4]H2O, isomorphe du sel ferreux correspondant ; le carbonate MnCO3, peu soluble, isomorphe de la calcite ; le sulfure MnS, peu soluble.
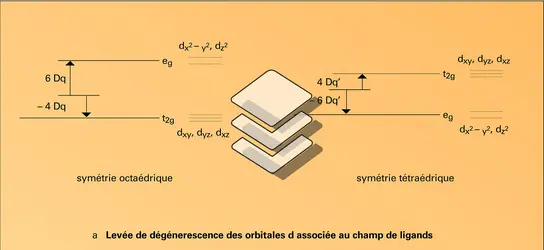
Le Mn(II) a pour structure électronique 4s0 3d5. On note quelques rares exemples de complexes à spin faible avec les ligands les plus forts de la série spectrochimique. Un exemple est Mn (CN)64— (S=1/2). Mais Mn(II) est le plus souvent à spin fort avec cinq électrons non appariés (S=5/2). Quelle que soit la géométrie, l'énergie de stabilisation du champ de ligands (E.S.C.L.) est alors nulle. La géométrie est donc imposée, non par la stabilisation électronique, mais par des critères de répulsion stérique entre ligands : les géométries octaédrique et tétraédrique, qui minimisent ces interactions stériques, sont favorisées. Le Mn(II) possédant un rayon ionique assez élevé (0,097 nm pour l'espèce à spin fort en coordination octaédrique), la géométrie octaédrique sera la plus fréquente. On la rencontre dans [Mn(H2O)6]2+. Il existe aussi des exemples de complexes tétraédriques, qui sont le plus souvent des espèces anioniques du type[...]
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Bernard DUBOIS : professeur à l'École nationale supérieure de chimie de Paris et à l'université de Paris-VI
- Jacques FAUCHERRE : ancien directeur du laboratoire de chimie minérale de l'université de Paris-VII, professeur honoraire de chimie
- Gil MICHARD : docteur ès sciences, professeur à l'université de Paris-VII
- Clotilde POLICAR : professeur agrégée de sciences physiques, maître de conférences à l'université de Paris-XI
- Jean-Louis VIGNES : professeur d'université à l'I.U.F.M. de Créteil, chercheur au Centre d'études de chimie métallurgique (C.N.R.S.)
Classification
Pour citer cet article
Bernard DUBOIS, Jacques FAUCHERRE, Gil MICHARD, Clotilde POLICAR et Jean-Louis VIGNES. MANGANÈSE [en ligne]. In Encyclopædia Universalis. Disponible sur : (consulté le )
Médias
Autres références
-
ACIER - Technologie
- Écrit par Louis COLOMBIER, Gérard FESSIER, Guy HENRY, Joëlle PONTET
- 14 176 mots
- 10 médias
Le manganèse intervient également dans tous les aciers comme désoxydant. Dans les aciers alliés, il se comporte, dans un certain sens, comme le nickel ; il augmente la trempabilité, permet d'obtenir des aciers à structure austénitique stable. Mais il participe à la formation de carbures et se trouve... -
AIMANTS
- Écrit par Roger FONTAINE
- 6 273 mots
- 13 médias
Un autre exemple de matériau à réaction désordre-ordre se trouve, pour certaines compositions, dans les alliages manganèse-aluminium. Ainsi, l'alliage de composition 72 p. 100 Mn, 28 p. 100 Al à structure hexagonale à haute température se transforme à 700 0C en une phase tétragonale... -
CARBONATES
- Écrit par Marc DARDENNE, André JAUZEIN
- 5 049 mots
- 12 médias
Ce minéral a aussi été appelé « dialogite » à cause de l'incertitude qui régnait à l'origine sur sa composition. La substitution du fer ferreux ou du calcium au manganèse est la plus fréquente. Lorsqu'elle existe, la couleur rose (en grec, rhodochros) est caractéristique de ce minéral,... -
EAU - Approvisionnement et traitement
- Écrit par Georges BREBION, Cyrille GOMELLA, Bernard LEGUBE
- 10 057 mots
- 5 médias
Le fer et lemanganèse sont présents sous forme dissoute (réduite) dans les eaux souterraines, eaux qui sont également appauvries en oxygène et riches en anhydride carbonique. Il faut donc effectuer une aération. Pour cela, l'eau traverse un lit de percolation, constitué de matériaux naturels... - Afficher les 14 références
Voir aussi
- ENZYMES
- LIGNINE
- HYDROSPHÈRE
- CATALASE
- FERROMANGANÈSE
- SILICOMANGANÈSE
- MANGANATES
- MANGANÈSE-PEROXYDASE
- POTENTIEL D'OXYDORÉDUCTION
- EXTRACTION, métallurgie
- BIOXYDE DE MANGANÈSE
- LECLANCHÉ PILE
- ACIER, technologie
- FERRO-ALLIAGES
- HYPOMANGANATES
- DOSAGE, chimie
- LIGAND ou COORDINAT, chimie
- DEGRÉ D'OXYDATION
- OXYDATION
- OXYDANTS
- PILES & ACCUMULATEURS
- SITE ACTIF, biochimie
- PERMANGANATES
- TRANSITION MÉTAUX DE
- RÉDUCTION, chimie
- OXYDORÉDUCTIONS, biologie
- NODULES POLYMÉTALLIQUES
- SUPEROXYDE DISMUTASE
- OXYDES
- PEROXYDASES
- JAHN-TELLER EFFET
- CYCLE GÉOCHIMIQUE
- HYDROTHERMALISME OCÉANIQUE ET SOURCES HYDROTHERMALES SOUS-MARINES
- PERMANGANATE DE POTASSIUM
- COORDINATION COMPOSÉS DE