HYDROGÈNE LIAISON
Articles
-
LIAISONS CHIMIQUES - Liaison hydrogène
- Écrit par André JULG
- 3 328 mots
- 2 médias
Les propriétés chimiques des composés possédant des groupements OH mettent en évidence l'existence d'associations entre les molécules par l'intermédiaire de ces groupements. L'énergie de ces associations est en général beaucoup plus faible que les énergies rencontrées pour les liaisons entre les...
-
ACIDES & BASES
- Écrit par Yves GAUTIER, Pierre SOUCHAY
- 12 364 mots
- 7 médias
Lorsque le proton d'un acide se trouve, de par la structure moléculaire, dans le voisinage d'un atome porteur de doublets libres, il peut y avoir formation d'une liaison hydrogène, qui renforce l'acidité, car, H étant sollicité par l'atome donneur, la liaison OH se trouve relâchée. C'est le... -
ADN (acide désoxyribonucléique) ou DNA (deoxyribonucleic acid)
- Écrit par Michel DUGUET, Universalis, David MONCHAUD, Michel MORANGE
- 10 074 mots
- 10 médias
La rupture des liaisons hydrogène entre les bases nécessite un apport d'énergie. Elle est réalisée par des enzymes baptisées hélicases. Celles-ci se fixent sur une région simple brin de l'ADN et progressent ensuite le long de ce brin en déplaçant l'autre brin de la double hélice. L'énergie est apportée... -
ALCOOLS
- Écrit par Jacques METZGER
- 5 832 mots
- 8 médias
...La présence de la fonction hydroxyle entraîne, pour les alcools, un ensemble de propriétés physiques particulières : les molécules sont polaires et associées par des liaisons hydrogène. Surtout sensible pour les premiers termes, cette association intermoléculaire se traduit par un ensemble de propriétés... -
AMIDES
- Écrit par Jacques METZGER
- 1 921 mots
- 3 médias
...secondaires existent sous deux formes isomères en équilibre, l'espèce « imino-alcool » étant très peu abondante, sauf dans le cas des lactames (formule 10). Ce sont des molécules associées par liaison hydrogène, principalement à l'état de dimères (formule 11), mais également sous la forme de ... -
AMMONIAC
- Écrit par Henri GUÉRIN
- 5 033 mots
- 5 médias
Ces anomalies s'expliquent par l'existence de liaisons hydrogène entre les atomes d'hydrogène d'une molécule et les atomes d'azote de molécules différentes. -
EAU - Propriétés physico-chimiques
- Écrit par Antoine POTIER
- 2 238 mots
- 4 médias
...d'électrons libres. Les deux paires et les deux liaisons sont orientées tétraédriquement, comme dans la glace Ih, dans laquelle il y a des liaisons hydrogène (liaisons H) O—H...O résultant de l'interaction entre l'hydrogène d'une liaison O—H d'une première molécule d'eau et une paire d'électrons libre... -
GLACE
- Écrit par Louis LLIBOUTRY
- 7 940 mots
- 9 médias
...centre d'un tétraèdre régulier formé par les quatre atomes d'oxygène les plus proches, situés à 0,2767 nm, auxquels il est lié par l'intermédiaire des liaisons hydrogène. L'angle entre deux liaisons hydrogène est de 109,470. Cette liaison est due au fait que les atomes d'hydrogène (ou plus exactement... -
HÉMOGLOBINE
- Écrit par Max Ferdinand PERUTZ
- 3 883 mots
- 7 médias
...histidines, dite proximale, est liée à l'atome de fer de l'hème (fig. 5). L'autre histidine, dite distale, s'attache du côté opposé de l'hème par une liaison hydrogène avec l'oxygène fixé. À part ces chaînons histidine, la plupart des autres chaînons étant hydrocarbonés, l'extérieur de la molécule d'hémoglobine... -
HYDROGÈNE
- Écrit par Paul HAGENMULLER
- 3 539 mots
- 6 médias
La liaison hydrogène se forme entre un groupement porteur d'un atome d'hydrogène AH et un accepteur de proton B, appartenant ou non à la même molécule s'il s'agit de composés organiques. A est un atome d'azote ou d'oxygène, B un atome d'azote, d'oxygène, de ... -
LIAISONS CHIMIQUES - Liaison et classification
- Écrit par André JULG
- 8 249 mots
- 7 médias
Lesliaisons hydrogène résultent de l'association entre une molécule A − H et un groupement B porteur d'une paire d'électrons. On les note : A − H ... B. A peut être un atome d'oxygène, d'azote, de soufre, de carbone ; B, un oxygène, un azote, un halogène...... -
LIAISONS CHIMIQUES - Liaisons biochimiques faibles
- Écrit par Antoine DANCHIN
- 5 900 mots
- 9 médias
Dansla plupart des macromolécules biologiques, des liaisons hydrogène participent pour une part importante à la structure spatiale obtenue, et elles sont, en particulier, fondamentales dans l'appariement des nucléotides qui constituent les acides nucléiques. Pourtant, leur contribution, qui ne peut... -
MATIÈRE (physique) - État solide
- Écrit par Daniel CALÉCKI
- 8 629 mots
- 12 médias
...les atomes voisins ; c'est ainsi qu'un atome d'hydrogène établit une liaison entre deux atomes du type oxygène, azote ou fluor. Ce mécanisme porte le nom deliaison hydrogène ; il est à l’œuvre dans les cristaux de glace, dont on connaît actuellement une douzaine de variétés allotropiques. -
MATIÈRE (physique) - État liquide
- Écrit par Jean-Louis RIVAIL
- 3 243 mots
- 6 médias
...très anisotrope lorsque les deux molécules peuvent établir entre elles des liaisons chimiques faibles mais dirigées. Elles sont connues sous le nom de liaisons hydrogène, comme celles qui se forment entre deux molécules d'eau voisines (cf. eau - Propriétés physico-chimiques). Ces liaisons intermoléculaires... -
MOLÉCULE
- Écrit par André JULG
- 4 301 mots
...présentes à l'état gazeux, de sorte que la définition de la molécule devient floue. Ainsi, dans l'eau liquide, les diverses molécules H2O de la vapeur se retrouvent plus ou moins liées entre elles par des « liaisons faibles » dites liaisons hydrogène, qui se font et se défont au hasard des chocs. -
NUCLÉIQUES ACIDES
- Écrit par Jacques KRUH, Ethel MOUSTACCHI, Michel PRIVAT DE GARILHE, Alain SARASIN
- 13 468 mots
- 17 médias
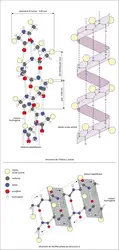
...latin catena, « chaîne ») grâce à l'« appariement » des bases se faisant vis-à-vis sur l'une et l'autre chaîne (fig. 4) : les appariements sont toujours adénine-thymine (deux liaisons non covalentes ou liaisons hydrogène) et guanine-cytosine (trois liaisons non covalentes). -
ORIGINE DE LA VIE
- Écrit par André BRACK
- 11 477 mots
...systèmes vivants. La majorité des constituants des cellules, et en particulier les protéines et les acides nucléiques, doivent leurs propriétés aux liaisons hydrogène qu'ils échangent entre eux, mais aussi avec l'eau. D'une manière générale, une liaison hydrogène, de nature essentiellement électrostatique,... -
PHARMACOLOGIE
- Écrit par Edith ALBENGRES, Jérôme BARRE, Pierre BECHTEL, Jean-Cyr GAIGNAULT, Georges HOUIN, Henri SCHMITT, Jean-Paul TILLEMENT
- 20 323 mots
- 9 médias
...la complémentarité des deux partenaires illustrée par le couple clé-serrure. Elle résulte de la formation d'interactions de différents types : liaisons hydrogènes, interactions ioniques et hydrophobes (tabl. 3) qui dépendent non seulement de la nature des fonctions chimiques en présence, mais également... -
PHARMACORÉCEPTEURS, biochimie
- Écrit par Philippe COURRIÈRE
- 596 mots
- 1 média
Notion introduite pour la première fois par J. N. Langley et P. Ehrlich à propos de l'action d'une drogue. Langley observa, en effet, en 1909, que la nicotine, qui est un excitant ganglionnaire, provoquait une réponse quand on l'appliquait localement sur certaines parties du tissu musculaire...
-
PROTÉINES - Structures
- Écrit par Philippe BRION, Universalis, René LAFONT
- 6 273 mots
- 6 médias
...résidus.Une caractéristique remarquable des chaînes polypeptidiques repliées est que certains segments adoptent des conformations – stabilisées par des liaisons hydrogène faibles en énergie – dans lesquelles les angles de torsion Φ et ψ se répètent de façon régulière. Ces segments réguliers constituent... -
SOLVANTS
- Écrit par Jacques DEVYNCK
- 1 796 mots
- 1 média
Les interactions spécifiques sont liées à la nature chimique du solvant. Ce sont de véritables liaisons chimiques entre soluté et solvant. Lesliaisons hydrogène sont spécifiques des solvants protiques (susceptibles d'échanger des ions H+), comme l'eau, les alcools, les acides carboxyliques...
Médias