HÉMOPROTÉINES
Articles
-
DÉTOXICATION
- Écrit par Jean-Paul LEROUX
- 2 775 mots
- 4 médias
Enzymes majeures de phase I, les monooxygénases à cytochrome P-450 sont des hémoprotéines (contenant donc du fer), comme l'hémoglobine, mais elles s'en distinguent par leur activité catalytique. En l'absence de substrat, le fer des cytochromes P-450 est à l'état ferrique (Fe III). Après... -
FER - Rôle biologique du fer
- Écrit par Carole BEAUMONT
- 4 731 mots
- 3 médias
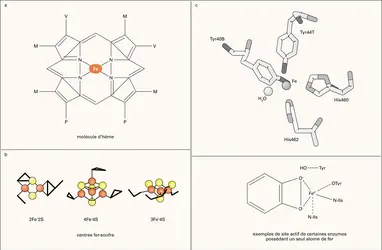
Chez les hémoprotéines, le fer est présent sous forme d'hème, lié aux quatre noyaux pyrroles d'une molécule de porphyrine IX (fig. 1a). L'hème est le groupement prosthétique de protéines de transport d'oxygène (hémoglobine, myoglobine), d'activateurs de l'oxygène moléculaire (cytochrome P450, cytochromes... -
HÉMOGLOBINE
- Écrit par Max Ferdinand PERUTZ
- 3 883 mots
- 7 médias
Médias