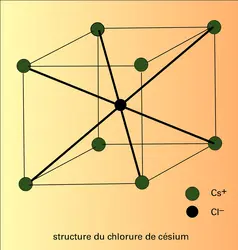
CRISTAL IONIQUE
Articles
-
ATOME
- Écrit par José LEITE LOPES
- 9 140 mots
- 13 médias
...ne peut pas être expliquée par la physique classique – il faut considérer aussi les forces de liaison hétéropolaire. Ces forces se manifestent dans les cristaux ioniques dont le réseau cristallin est constitué d'ions métalliques, positifs et d'ions métalloïdiques, négatifs, comme celui du chlorure de sodium.... -
CRISTAUX
- Écrit par Marc AUDIER, Michel DUNEAU
- 7 291 mots
- 2 médias
L'exemple le plus courant de ces structures est le sel de cuisine, ou chlorure de sodium, de formule NaCl. Les structures ioniques sont caractérisées par la présence de deux types d'atomes, A et B, dont l'un a tendance à s'ioniser positivement, en cédant un ou plusieurs électrons (A... -
ÉLECTROLYTES
- Écrit par Georges KAYAS
- 644 mots
On classe sous ce vocable l'ensemble des conducteurs ayant la propriété de conduire le courant électrique par transport simultané de matière vers les électrodes. Appartiennent à ce groupe les acides, les bases et les sels, à l'état fondu ou en solution, ainsi que certains cristaux dit ioniques....
-
IONIQUES STRUCTURES
- Écrit par Michel POUCHARD
- 2 122 mots
- 5 médias
Si la présence d' ions au sein de solutions salines ou de sels fondus semblait depuis longtemps bien établie, notamment par des études de conductivité électrique, l'extension de la notion d'ion à l'édifice cristallin reposait par contre sur un postulat dont le succès résidait essentiellement dans l'obtention...
-
MATIÈRE (physique) - État solide
- Écrit par Daniel CALÉCKI
- 8 629 mots
- 12 médias
Le prototype des cristaux ioniques est le sel gemme, NaCl, qui appartient à la famille des halogénures alcalins (NaCl, KCl, CsCl, KBr, etc.). Ces cristaux sont obligatoirement construits à partir de deux atomes différents : un atome monovalent (ne possédant qu'un électron de valence faiblement lié),...
Médias