COMBUSTION
La déflagration
C'est la flamme la plus courante, telle la flamme du réchaud à gaz, du bois, de la bougie. Celle du bec Bunsen est constituée de deux parties bien distinctes : le cône et le panache. Ces deux parties sont séparables. La flamme proprement dite, où se produit le plus gros de la combustion, est le cône. Comme cette combustion n'est pas complète, le mélange des gaz de combustion chauds avec l'air secondaire est à l'origine d'une deuxième flamme, à géométrie moins bien définie, ou panache. Il est facile de constater la présence d'hydrogène et d'oxyde de carbone à la sortie du cône, en effectuant une analyse.
À l'intérieur du cône le mélange combustible ne fait que s'échauffer, tandis que la combustion s'effectue uniquement au voisinage de la surface, à l'endroit où a lieu une émission lumineuse intense. L'épaisseur de cette zone est très faible, de l'ordre de un millième de millimètre. Les gaz ne séjournent donc que peu de temps dans la flamme (environ 10-7 s).
Un autre type de flamme, sensiblement hémisphérique, se propage dans un tube rempli par un mélange inflammable. On obtient une flamme plate et flottante, au moyen d'un brûleur spécial à plusieurs canaux, la pression ambiante étant extrêmement faible.
La flamme « théorique » est plate, elle aussi. On exagère généralement son épaisseur pour montrer que la réaction de combustion se produit dans un volume bien limité.
Propagation de la flamme
Il existe toujours un mouvement relatif entre le mélange combustible et la flamme : soit que le mélange se déplace, la flamme étant alors stabilisée sur un brûleur, soit que la flamme se propage dans un mélange statique contenu à l'intérieur d'un récipient. Il existe plusieurs méthodes pour mesurer la vitesse de propagation de la flamme.
Dans le cas où la flamme est fixe, on mesure sa surface et le débit du mélange gazeux. La mesure de la surface est relativement facile s'il s'agit d'un cône parfait. Dans la plupart des cas, il est nécessaire de photographier la flamme avec un agrandissement connu et de mesurer sa surface à partir de la photographie. La vitesse est donnée par l'équation : vitesse = débit/surface.
Si la flamme est mobile, il suffit de mesurer le temps qu'elle met pour parcourir l'intervalle entre deux points de repère placés le long du tube de propagation. La méthode de Le Chatelier utilise une caméra à tambour tournant qui cinématographie d'une manière continue le déplacement de la flamme entre les deux repères. La connaissance de l'agrandissement de la caméra et de sa vitesse de rotation permet de déduire très facilement la vitesse de propagation de la flamme, par une mesure de la trace rectiligne faite sur le film.
La vitesse d'une flamme augmente avec la pression. Elle passe par une valeur maximale pour un rapport combustible/comburant bien déterminé.
Le mécanisme de la propagation est surtout thermique. La tranche de mélange en cours de combustion échauffe la tranche de gaz immédiatement voisine qui s'enflamme à son tour. Il y a lieu de considérer aussi la projection de centres actifs de la réaction dans le mélange froid n'ayant pas encore réagi.
Inflammation, limite d'inflammabilité, extincteurs chimiques
Pour enflammer un mélange gazeux, il faut lui fournir localement une quantité d'énergie suffisante. Cette énergie peut être thermique, électrique (décharge d'un condensateur) ou simplement provenir d'une autre flamme.
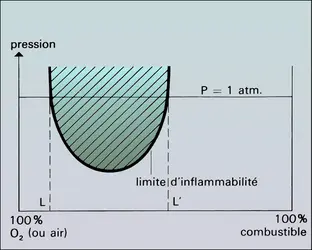
Un mélange combustible ne s'enflamme que dans certaines conditions de pression et de rapport combustible/comburant (ou concentration). Le diagramme pression-concentration représente par une zone hachurée les conditions paramétriques où l'inflammation est possible. Cette zone est limitée par une courbe dite « limite d'inflammabilité[...]
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Michel LUCQUIN : ingénieur diplômé de l'École nationale supérieure de chimie de Paris, professeur à l'université des sciences et techniques de Lille
Classification
Pour citer cet article
Michel LUCQUIN. COMBUSTION [en ligne]. In Encyclopædia Universalis. Disponible sur : (consulté le )
Médias
Autres références
-
ACÉTYLÈNE
- Écrit par Henri GUÉRIN
- 5 089 mots
- 6 médias
...endothermique (ΔH = 226,5 kJ/mole) est instable ; cela explique la facilité avec laquelle il donne lieu à des réactions de synthèse et sa grande chaleur de combustion (58 000 kJ/m3) :et aussi les risques d'explosions, dès qu'il est en présence d'air ou même en l'absence de celui-ci, lorsqu'on le comprime....
-
ALCANES
- Écrit par Jacques METZGER
- 3 614 mots
- 11 médias
La combustion des alcanes à l'air est une réaction fortement exothermique (réaction 4) qui est abondamment exploitée pour la production de chaleur (chauffage industriel et domestique) et d'énergie mécanique (moteurs à combustion interne, réacteurs). La chaleur de combustion des alcanes à ... -
AUTOMOBILE - Technologie
- Écrit par Georges BRESSON, Jean-Pierre CAPET, François de CHARENTENAY, Universalis, Thierry HALCONRUY, Frédéric RIVAS, Jean-Pierre VÉROLLET
- 15 879 mots
- 27 médias
Le succès de l'automobile a été assuré, et le demeure pour quelques décennies encore, par l'efficacité dumoteur thermique dit à combustion interne (cycle 4 temps) qui équipe plus de 98 p. 100 des voitures. Ce type de moteur transforme l'énergie chimique des carburants en énergie... -
BALISTIQUE
- Écrit par Jean GARNIER
- 2 100 mots
- 2 médias
...ou le mélange des trois. Cependant, en raison des difficultés de stockage, les propergols les plus employés sont solides ou liquides. Le contrôle de la combustion des propergols liquides s'effectue au moyen de mécanismes auxiliaires qui règlent la quantité de carburant admise dans la chambre de combustion.... - Afficher les 26 références
Voir aussi
- STŒCHIOMÉTRIE
- ONDE DE CHOC
- PRESSION, physique
- LIQUIDE ÉTAT
- ÉMISSION, physique
- CALORIFIQUE POUVOIR
- COMBUSTIBLES
- COMBURANTS
- VAPORISATION
- PLASMAS
- CALORIMÈTRE, thermique
- EXPLOSION
- GAZÉIFICATION
- INFLAMMATION, technologie
- OXYDATION
- DÉFLAGRATION
- DÉTONATION
- EXOTHERMIQUE RÉACTION
- EXTINCTEURS
- TEMPÉRATURE
- SOLIDES PHYSIQUE DES
- HYDROGÈNE CHALUMEAU À
- FLAMME
- BUNSEN BEC
- JUNKERS CALORIMÈTRE DE
- POUSSIÈRES
- CHALUMEAUX
- COUP DE POUSSIÈRES