ALDOLS & CÉTOLS
Préparations
α-aldols et cétols
L'hydrolyse directe des aldéhydes et cétones α-halogénés, d'accès facile, ne convient pas : on les transforme d'abord en acétates qu'on hydrolyse ou alcoolyse ensuite :

L'hydratation d'un alcool α-acétylénique, facilement obtenu par éthynylation d'un aldéhyde ou d'une cétone, conduit à un α-cétol :

Les acyloïnes aromatiques Ar-CHOH-CO-Ar sont obtenues par condensation d'un aldéhyde sous l'action catalytique du cyanure de potassium (réaction 1). En série aliphatique, ce sont les esters que l'on condense en présence de sodium ; il se forme le sel disodique d'un énediol qui, hydrolysé, s'isomérise en α-cétol :

L'aldéhyde glycolique est préparé industriellement par oxydation ménagée du glycol :

β-aldols et cétols
Les β-aldols résultent de l'action, sur les aldéhydes énolisables, de bases moyennement fortes comme KCN, Na2CO3 ou NaOH diluée :
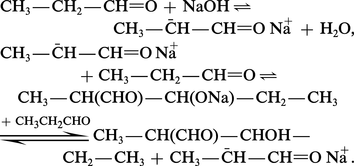
Des bases plus fortes, comme la potasse alcoolique, provoquent une répétition de l'aldolisation qui conduit à des produits lourds de polycondensation.
L'aldolisation mixte résulte de la réaction de condensation, dans les mêmes conditions, de deux aldéhydes, l'un énolisable et l'autre non. Le premier est transformé par la base catalyseur en énolate nucléophile qui attaque la fonction carbonyle du second :


Celui-ci est utilisé pour la fabrication de résines alkyde, matières premières de l'industrie des peintures ; le tétranitrate est employé comme explosif, et les esters d'acides gras supérieurs servent d'additifs pour huiles, de plastifiants et d'émulgateurs.
Les β-cétols se forment, dans des réactions comparables, à partir de cétones énolisables seules ou en mélange avec des aldéhydes :

L'ensemble des réactions est réversible mais, à la différence de l'aldolisation, l'équilibre correspond à une très faible concentration en cétol, de sorte que, pour produire ce dernier, il doit être déplacé. Le diacétone alcool se prépare généralement en mettant en contact l' acétone et le catalyseur solide oxyde de baryum : l'acétone est portée à ébullition dans un ballon surmonté d'un Soxhlet dont la cartouche renferme la baryte. La condensation se réalise au contact du catalyseur et le liquide qui retombe dans le ballon contient d'abord de faibles quantités de cétol, puis il s'enrichit lentement ; en effet, en l'absence de catalyseur dans le ballon, la réaction inverse de rétrocétolisation ne se produit pas. Quand la teneur en cétol avoisine 30 p. 100, on chasse l'acétone en excès sous pression réduite.
Lors de la cétolisation mixte entre aldéhyde et cétone, de faibles quantités de ces deux composés sont réversiblement transformées en énolates. Chacun de ces derniers, réactifs nucléophiles, peut attaquer, réversiblement, soit l'aldéhyde, soit la cétone : du fait de l'équilibre défavorable de la réaction d'une cétone sur un énolate, la condensation résulte de l'attaque de l'aldéhyde par celui de la cétone et le produit obtenu est le β-cétol (réaction de Claisen-Schmidt) [réaction 2]. Une étape importante de la synthèse industrielle de la vitamine A fait intervenir la condensation de[...]
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Jacques METZGER : professeur de chimie organique à la faculté des sciences de Marseille
. In Encyclopædia Universalis []. Disponible sur : (consulté le )
Médias
Autres références
-
ALDÉHYDES ET CÉTONES
- Écrit par Jacques METZGER
- 7 350 mots
- 4 médias
Aldolisation.Les aldéhydes énolisables, c'est-à-dire qui possèdent un atome d'hydrogène sur le carbone en α du groupe carbonyle, se dimérisent sous l'influence catalytique de bases ou d'acides (soude diluée, carbonate de sodium, cyanure alcalin, acétate de sodium ou acide chlorhydrique ou sulfurique... -
ÉTHANAL ou ACÉTALDÉHYDE ou ALDÉHYDE ACÉTIQUE
- Écrit par Dina SURDIN
- 453 mots
Appelé parfois improprement acétaldéhyde, aldéhyde acétique
ou aldéhyde éthylique
CH3—CHO
Masse moléculaire : 44,05 g
Point d'ébullition : + 21 0C
Liquide incolore, inflammable, à odeur caractéristique, infiniment soluble dans l'eau, l'éthanol, l'éther, le ...
Voir aussi





