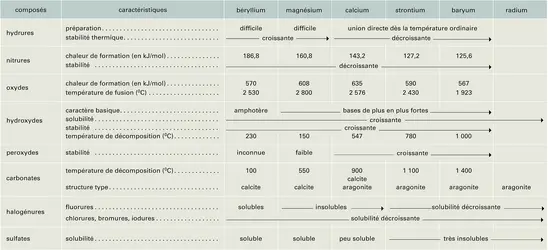
ALCALINO-TERREUX
Articles
-
MÉTAUX - Métaux alcalino-terreux
- Écrit par Jean PERROTEY
- 2 578 mots
- 2 médias
-
BARYUM
- Écrit par Bernard CARTON
- 330 mots
Du grec barus, lourd
Symbole chimique : Ba
Numéro atomique : 56
Masse atomique : 137,34 g
Point de fusion : 725 0C
Point d'ébullition : 1 640 0C
Densité (à 20 0C) : 3,5.
Deuxième membre de la famille des alcalinoterreux (après le calcium), dont C. W. Scheele découvrit la base (baryte)...
-
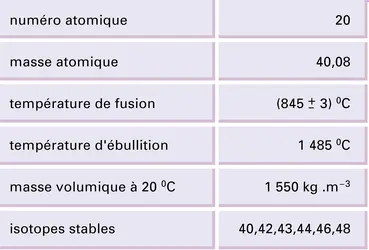
CALCIUM
- Écrit par Jean PERROTEY
- 2 292 mots
- 2 médias
Le calcium, élément chimique de symbole Ca et de numéro atomique 20, est le plus léger des métaux alcalinoterreux vrais. Il représente environ 3,45 p. 100 du poids de la croûte terrestre et se classe, par ordre d'abondance, au troisième rang des métaux, derrière l'aluminium et...
-
HYDROXYDES
- Écrit par Bertrand DREYFUS
- 182 mots
Composés chimiques contenant un ou plusieurs groupes d'ions hydroxyles (OH—). Le cation est en général un ion métallique (Na, K, Mg, Ca, Al) ou un radical organique (comme le tétraméthylammonium).
Les hydroxydes sont des bases plus ou moins fortes, les plus fortes étant celles des métaux...
-
MAGNÉSIUM
- Écrit par Maurice HARDOUIN, Michel SCHEIDECKER
- 4 273 mots
- 8 médias
Les propriétés chimiques sont dominées par la très grande réactivité du métal qui se rapproche, sur ce point, des métaux alcalino-terreux. La chaleur d'oxydation est très grande, ce qui en fait un réducteur très énergique d'un grand nombre de chlorures métalliques. Cette réaction est utilisée... -
NUTRITION
- Écrit par René HELLER, Raymond JACQUOT, Alexis MOYSE, Marc PASCAUD
- 13 655 mots
- 15 médias
Le calcium n'est pas nécessaire aux champignons, mais chez les végétaux supérieurs son rôle est primordial. C'est un constituant de la lamelle moyenne de la membrane cellulaire (pectate de calcium) ; c'est aussi un antitoxique à l'égard des acides organiques en excès ; il entre dans la constitution de... -
RADIUM
- Écrit par Georges BOUISSIÈRES
- 2 329 mots
- 1 média
Conformément à sa position dans le groupe IIa de la classification périodique, la structure électronique du radium est : [Rn] + 7s2. C'est l'élément le plus électropositif des métaux alcalino-terreux. Le potentiel normal calculé du couple Ra2+/Ra est EH = — 2,92 V ; le potentiel... -
RYDBERG JOHANNES ROBERT (1854-1919)
- Écrit par Georges KAYAS
- 198 mots
Physicien suédois né à Halmstad et mort à Lund. Johannes R. Rydberg effectue ses études à l'université de Lund, où il sera nommé professeur en 1901. Lauréat de mathématiques (1879), Rydberg s'oriente vers la physique et plus particulièrement vers l'étude des spectres optiques des éléments....
-
STRONTIUM
- Écrit par Bernard CARTON
- 300 mots
De Strontian, ville d'Écosse.
Symbole chimique : Sr
Numéro atomique : 38
Masse atomique : 87,62
Point de fusion : 769 0C
Point d'ébullition : 1 384 0C
Densité (à 20 0C) : 2,54
Métal alcalinoterreux mou, de reflet argenté quand il est fraîchement coupé, de couleur jaunâtre si on l'expose...
Médias