AÉRONOMIE
Formation de nouveaux constituants
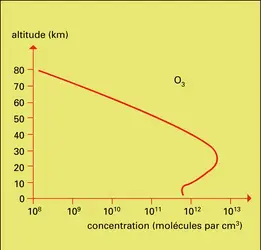
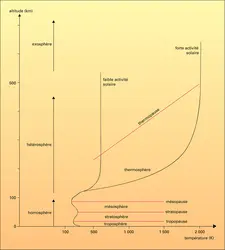
Comme le rayonnement solaire est capable de photodissocier et d'ioniser certains constituants atmosphériques, il est évident que les produits de ces processus peuvent réagir chimiquement avec d'autres composés et donner naissance à toute une chimie aéronomique qui est parfois difficile à réaliser au laboratoire, car les conditions de température et de pression rencontrées dans les diverses régions atmosphériques ne sont pas aisément reproductibles. De nouveaux constituants atmosphériques apparaissent et sont susceptibles d'influencer à leur tour la structure de l'atmosphère. En partant de l' oxygène moléculaire (O2), dont la première limite de dissociation est à 242,4 nm, le rayonnement solaire produit des atomes d'oxygène suivant le mécanisme :

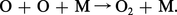
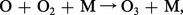
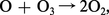



La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Gaston KOCKARTS : chef de département à l'Institut d'aéronomie spatiale
Classification
Pour citer cet article
Gaston KOCKARTS. AÉRONOMIE [en ligne]. In Encyclopædia Universalis. Disponible sur : (consulté le )
Médias
Autres références
-
BLAMONT JACQUES (1926-2020)
- Écrit par Marie-Lise CHANIN
- 1 128 mots
- 1 média
...la faculté des sciences de Paris, il fonde en 1958 le premier laboratoire français consacré à la recherche scientifique depuis l’espace : le Service d’aéronomie. Il en sera le directeur de 1962 à 1985. Chargé de la contribution française à l’Année géophysique internationale (AGI, juillet 1957-décembre...
Voir aussi
- IONISATION
- RAYONNEMENT SOLAIRE
- EXOSPHÈRE
- HOMOSPHÈRE
- HÉTÉROSPHÈRE
- MÉSOSPHÈRE & MÉSOPAUSE
- TROPOSPHÈRE & TROPOPAUSE
- STRATOSPHÈRE & STRATOPAUSE
- THERMOSPHÈRE
- TEMPÉRATURE, météorologie et climatologie
- ABSORPTION ATMOSPHÉRIQUE
- DISSOCIATION MOLÉCULAIRE ÉNERGIE DE
- ÉCLAIREMENT
- VENT SOLAIRE
- CHAMP MAGNÉTIQUE TERRESTRE ou CHAMP GÉOMAGNÉTIQUE
- CYCLE SOLAIRE
- MONTRÉAL PROTOCOLE DE (1987)
- ACTIVITÉ SOLAIRE
- ATMOSPHÈRE, chimie
- ATMOSPHÈRE, planétologie
- PHOTODISSOCIATION
- CONSTANTE SOLAIRE
- CHLOROFLUOROCARBURES (CFC)
- POLLUTION ATMOSPHÉRIQUE ou POLLUTION DE L'AIR