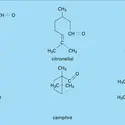
ACÉTALS
Préparations et modes de formation
La méthode la plus générale de préparation des acétals d'aldéhydes et d'alcools primaires et secondaires est l'action d'une quantité catalytique d'acide chlorhydrique gazeux et sec sur une solution de l'aldéhyde dans un excès d'alcool. Cette synthèse échoue dans le cas des cétones pour lesquelles les équilibres sont défavorables.
Une autre méthode est la transéthérification mettant en œuvre, en catalyse acide, l'aldéhyde ou la cétone à acétaliser et un acétal particulier : l'orthoformiate d'éthyle (réaction 2).
Une méthode usuelle de protection des fonctions alcool primaire ou secondaire et phénol, consiste à les faire réagir avec certains éthers d'énols comme le dihydropyranne : l'acétal tétrahydropyrannique formé est stable vis-à-vis des bases, des nucléophiles, des agents oxydants et peut régénérer sans difficulté l'alcool ou le phénol, après réaction sur la chaîne, par traitement doux avec un acide dilué (réaction 3).
Les acétals, dissymétriques ou non, peuvent être obtenus par action d'un alcoolate de sodium sur un éther chlorométhylique (réaction de Williamson).
Les organomagnésiens conduisent à des acétals par réaction avec les orthoesters et l'orthocarbonate d'éthyle.
L'autoaddition des aldéhydes, en catalyse acide, conduit à des triacétals cycliques appelés trioxannes ou des polyacétals linéaires.
La suite de cet article est accessible aux abonnés
- Des contenus variés, complets et fiables
- Accessible sur tous les écrans
- Pas de publicité
Déjà abonné ? Se connecter
Écrit par
- Jacques METZGER : professeur de chimie organique à la faculté des sciences de Marseille
Classification
Pour citer cet article
Jacques METZGER. ACÉTALS [en ligne]. In Encyclopædia Universalis. Disponible sur : (consulté le )
Média
Autres références
-
ALDÉHYDES ET CÉTONES
- Écrit par Jacques METZGER
- 7 350 mots
- 4 médias
...à un hémiacétal instable. Une transprotonation suivie de l'attaque (SN2) d'une seconde molécule d'alcool conduit réversiblement à l' acétal, avec élimination d'une molécule d'eau. Ce dernier est stable. L'acétalisation des cétones est plus difficile par suite, probablement, de l'augmentation... -
GÉMINATION, chimie
- Écrit par Dina SURDIN
- 88 mots
Processus par lequel deux substituants identiques se fixent sur un même carbone. Ainsi le dibromo-1,1-éthane peut également être appelé gem-dibromoéthane. Ce terme indique donc la position relative des substituants. Un carbone peut être gem-disubstitué par des groupements fonctionnels monovalents....
-
OXOLANES
- Écrit par Dina SURDIN
- 62 mots
Composés hétérocycliques à cinq chaînons, comportant un atome d'oxygène. On peut donc les considérer comme des éthers cycliques. L'exemple le plus simple en est le tétrahydrofuranne.
De la même manière, les dioxolanes comportent deux atomes d'oxygène dans un cycle à cinq chaînons...
Voir aussi