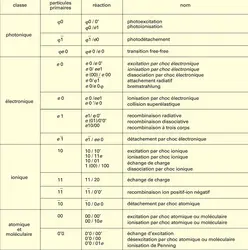
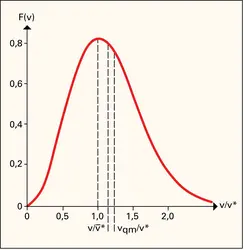
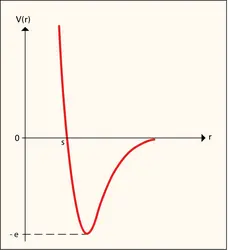
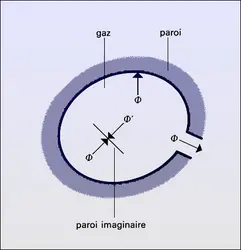
État gazeux
Articles
-
AIR
- Écrit par Jean PERROTEY
- 2 154 mots
- 2 médias
Le globe terrestre est entouré d'une atmosphère constituée d'un mélange gazeux nommé air, qui s'étend de la surface du sol jusqu'à une altitude d'environ 150 kilomètres.
La pression de l'air au niveau de la mer a longtemps servi d'unité de pression (atmosphère) ; elle...
-
CHIMIE - Histoire
- Écrit par Élisabeth GORDON, Jacques GUILLERME, Raymond MAUREL
- 11 186 mots
- 7 médias
La chimie est la science des transactions et des créations matérielles. Par elle se fonde la « cité culturelle » du matérialisme dont le champ est à jamais ouvert et illimité. La production d'idées et d'expériences qu'elle engendre dépasse, comme le rappelait opportunément Gaston Bachelard, la...
-
CINÉTIQUE DES FLUIDES THÉORIE
- Écrit par Jean-Loup DELCROIX
- 9 801 mots
- 15 médias
La théorie cinétique des fluides appartient à une branche de la physique qui se propose d'expliquer les propriétés macroscopiques des fluides à partir d'une analyse statistique des mouvements des particules qui les constituent. On peut classer les fluides en trois grandes familles : gaz, liquides,...
-
ÉLASTICITÉ ET COMPRESSIBILITÉ DE L'AIR
- Écrit par Bernard PIRE
- 112 mots
- 1 média
Par ses expériences sur l'élasticité et la compressibilité de l'air, le physicien et chimiste irlandais Robert Boyle (1627-1691) établit en 1661 les bases nécessaires à ce qui deviendra connu sous le nom de loi de Boyle-Mariotte, par référence aux travaux simultanés du Français ...
-
GAZ ANALYSE DES
- Écrit par Henri GUÉRIN
- 6 540 mots
- 9 médias
Étant donné les propriétés spécifiques des gaz, les techniques mises au point pour les analyser se différencient nettement des méthodes de la chimie analytique classique.
De très nombreuses fabrications chimiques, et notamment les grandes synthèses industrielles, font intervenir des gaz dont...
-
MAGNÉTOHYDRODYNAMIQUE (MHD)
- Écrit par Jean-Loup DELCROIX
- 4 378 mots
- 14 médias
La magnétohydrodynamique (M.H.D.) est une branche de la physique consacrée à l'étude des mouvements des fluides conducteurs de l'électricité en présence de champs magnétiques. Elle s'applique aux métaux liquides (mercure, métaux alcalins fondus), aux gaz faiblement ionisés et aux plasmas....
-
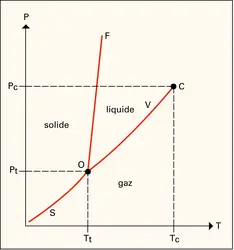
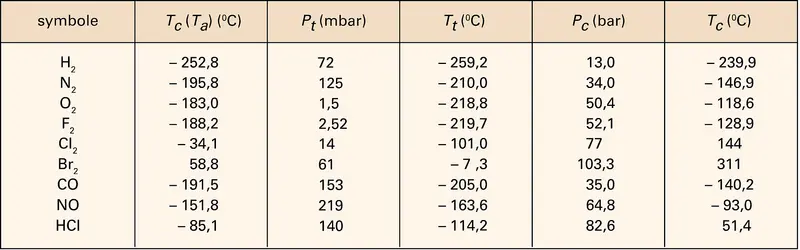
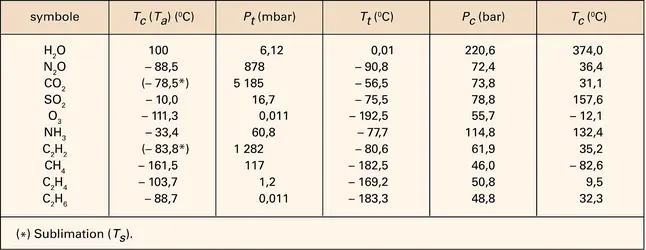
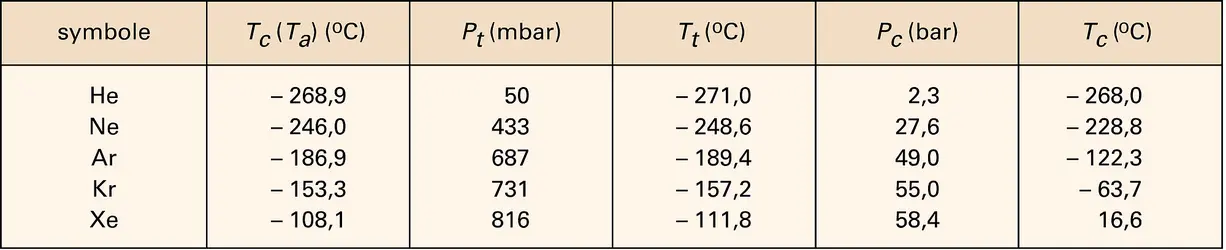
MATIÈRE (physique) - État gazeux
- Écrit par Henri DUBOST, Jean-Marie FLAUD
- 8 132 mots
- 7 médias
L'état sous lequel se présente la matière, solide, liquide ou gazeux, dépend des conditions de température et de pression. Suivant l'usage généralement admis, on désigne par gaz tout corps existant dans cet état dans les conditions normales de température et de pression (P0 =...
-
MEMBRANES, transferts
- Écrit par Michel RUMEAU
- 5 885 mots
- 10 médias
Si les propriétés des membranes sont connues depuis le début du xviiie siècle, leurs applications ne sont apparues, en laboratoire, que vers le milieu du xixe siècle et, dans l'industrie, dans la seconde moitié du xxe siècle.
Philippe de La Hire (1640-1718) est le premier à montrer que...
-
MOUVEMENT BROWNIEN
- Écrit par Didier ROUX
- 635 mots
- 2 médias
Comme le rappelle son nom, le mouvement brownien a été découvert en 1827 par le botaniste Robert Brown (1773-1858). C'est en observant sous un microscope du pollen dispersé dans de l'eau qu'il remarqua que les grains microscopiques le constituant étaient soumis à un mouvement continuel et irrégulier....
-
PNEUMATIQUE CHIMIE
- Écrit par Pierre LASZLO
- 1 055 mots
L'expression chimie pneumatique, loin de désigner une doctrine établie, se rapporte à une période de l'histoire de la chimie, qui prend place dans la seconde moitié du xviiie siècle. L'étude de divers gaz obligea de renoncer à l'ancienne doctrine, héritée de la scolastique, des quatre...
- 1
- 2